Que signifie supercritique ?
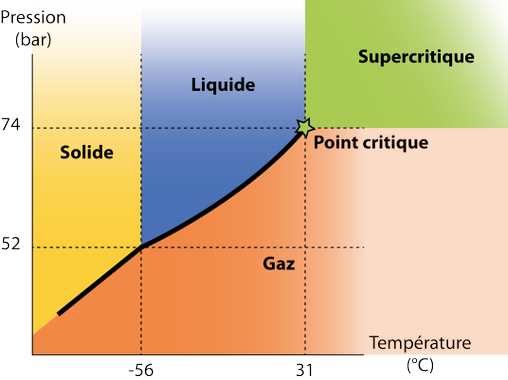
Tout corps pur possède un point critique correspondant à une pression et une température donnée Lorsque le corps pur est soumis à une pression et une température supérieures à celles de son point critique, ce corps pur est en phase dite "supercritique".
Il présente alors un comportement intermédiaire entre l’état liquide et l’état gazeux, avec des propriétés particulières : une masse volumique élevée comme celle des liquides, un coefficient de diffusivité intermédiaire entre celui des liquides et des gaz, et une faible viscosité (comme celles des gaz).
La courbe d’équilibre liquide-gaz est interrompue au niveau du point critique, assurant un continuum des propriétés physico-chimiques.
On parle ainsi de fluide supercritique lorsqu'un fluide est chauffé au-delà de sa température critique et lorsqu'il est comprimé au-dessus de sa pression critique. Ce comportement de la matière a été observé pour la première fois en 1822 par un ingénieur et physicien français, Charles Cagniard de La Tour. Il a ensuite été utilisé sous le terme de fluide supercritique par le chimiste irlandais Thomas Andrews.
Les fluides supercritiques : Comment cela fonctionne ?
Qu'est-ce que le CO2 supercritique ?
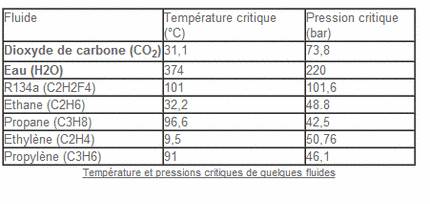
Le fluide le plus utilisé est le CO2 (dioxyde de carbone) du fait de ses propriétés fort intéressantes. Dans sa phase supercritique, il présente l’avantage d’être un solvant "vert" totalement neutre, non toxique, non polluant, non inflammable. Il peut être mis en oeuvre à des températures voisines de l'ambiante (sa température critique est de 31°C) et à des pressions élevées (sa pression critique est de 74 bar) mais facilement atteignables avec les technologies disponibles aujourd'hui. De plus, le CO2 est largement disponible à haute pureté et à bas prix.
Video : Passage à l'état supercritique
Qu'est-ce que l'eau subcritique et supercritique ?
Le point critique de l'eau est beaucoup plus élevé que celui du CO2, mais ses applications sont prometteuses, dont certaines sont en cours d'industrialisation.
L'eau dans sa phase subcritique (Pression : 15 à 100 bar ; Température : 150 à 250°C) peut solubiliser certains composés hydrophobes et peut donc être utilisée pour extraire des produits végétaux.
Concernant le traitement de déchets, le procédé utilisant l'eau subcritique est aussi appelé oxydation en voie humide.
L'eau dans sa phase supercritique (Pression > 221 bar; Température > 374°C) précipite les composés inorganiques et devient un solvant de la matière organique.
Les procédés utilisant l'eau supercritique sont également appelés procédés hydrothermaux.
Quels sont les autres fluides supercritiques ?
Outre l'eau et le CO2, des composés tel que l'éthane, le propane sont également utilisés dans leur phase supercritique pour certaines applications (extraction, réactions chimiques..)
A quoi cela sert ?
Les procédés fluides supercritiques permettent d'effectuer une large gamme d'opérations unitaires en fonction du fluide et des équipements utilisés.
De manière générale, les fluides supercritiques sont des outils pour :
- Lever des verrous technologiques
- Optimiser votre process de fabrication
- Trouver une alternative durable aux méthodes de production conventionelle
Inspirez vous des mots clés suivants, les plus fréquemment utilisés pour répondre à votre problématique industrielle :
| ATOMISER | EXTRAIRE | IMPREGNER |
| CONCENTRER | NETTOYER | POLYMERISER |
| CRISTALLISER | PULVERISER | RENFORCER |
| ENRICHIR | PURIFIER | SEPARER |
| STERILISER | SOLUBILISER | TRAITER |
